Información general Nombre: Guía de Manejo de Dolor por Cáncer Código CIE-10: No figura como dolor por cáncer; se pueden utilizar múltiples códigos dependiendo del área afectada, tiempo de evolución y enfermedad de base. H571. DOLOR OCULAR; M255: DOLOR EN ARTICULACION; M546:DOLOR EN LA COLUMNA DORSAL; M796: DOLOR EN MIEMBRO; R070: DOLOR EN GARGANTA; R074 DOLOR EN EL PECHO; R101: DOLOR EN LA PARTE SUPERIOR DEL ABDOMEN; R102: DOLOR PELVICO Y PERINEAL; R103: DOLOR LOCALIZADO EN OTRAS PARTES DEL ABDOMEN INFERIOR; R104: DOLOR ABDOMINAL NO ESPECIFICO; R520: DOLOR AGUDO; R521: DOLOR CRONICO INTRATABLE; R522: OTRO DOLOR CRONICO; R529: DOLOR NO ESPECIFICADO.
2.0 Introducción A pesar de los esfuerzos realizados en los últimos años por diferentes asociaciones interesadas en el control del dolor y los cuidados paliativos, el dolor en los pacientes con cáncer tiene una alta prevalencia; cerca del 80% de los pacientes no obtienen control adecuado del dolor debido a múltiples barreras que impiden que los analgésicos adecuados lleguen en forma oportuna y suficiente. En dos terceras partes de los pacientes, el dolor es secundario al tumor primario o a las metástasis, mientras que la tercera parte padece dolor secundario a la quimioterapia, radioterapia, cirugías, infecciones o por causas ajenas al cáncer. Los avances recientes en relación al tratamiento del dolor por cáncer se fundamentan en una mejor evaluación de los mecanismos que lo originan, permitiendo iniciar el tratamiento más adecuado que produzca un rápido alivio con un baja incidencia de efectos indeseables, en el reconocimiento y tratamiento de la neurotoxicidad inducida por opioides, en las ventajas derivadas de una adecuada rotación de opioides y en la introducción de nuevas formulaciones de opioides.
3.0 Definición y descripción clínica Entender adecuadamente el mecanismo involucrado en la producción del dolor permite instaurar un adecuado tratamiento analgésico. Durante la valoración inicial se debe determinar la localización, intensidad y etiología del dolor, valorar la presencia de otros síntomas e identificar los factores de mal pronóstico en el control del dolor como la presencia de dolor neuropático, dolor incidental, alteraciones cognitivas, psicológicas, historia de abuso de alcohol o adicción a drogas. Se debe medir la intensidad del dolor antes y durante el tratamiento para evaluar la eficacia del tratamiento instaurado.
4.0 Etiología – Fisiopatología Dependiendo del sitio de origen, el dolor neoplásico se puede clasificar en somático, visceral y neuropático. El dolor somático y el visceral se originan como consecuencia de la activación de los nociceptores (receptores de estímulos nocivos) que se encuentran en tejidos cutáneos, músculos, huesos y vísceras, como consecuencia, entre otras cosas, de la reacción inflamatoria desencadenada por el tumor en los diferentes tejidos, asociada a la liberación de mediadores químicos algogénicos (productores de dolor) que dan origen a la sensación y la envían al sistema nervioso central a través de fibras nerviosas especializadas que pasan por la médula espinal. El dolor neuropático se presenta por el daño del sistema nervioso central o periférico, secundario a compresión o infiltración tumoral de un nervio periférico o de la médula espinal o como consecuencia de un trauma o una lesión química del nervio, secundario a daño quirúrgico, a radioterapia o a quimioterapia; se caracteriza por ser tipo ardor, quemante, o se presenta como paroxismos de dolor que semejan descargas eléctricas. Más del 80% de los pacientes en estado avanzado de la enfermedad presentan dolor mixto. 2
5.0 Factores de riesgo Padecer cáncer
6.0 Diagnóstico Eminentemente clínico. En casos especiales en los que no es clara la etiología y sitio del dolor se pueden emplear ayudas diagnósticas, si del resultado depende la toma o cambio de conducta terapéutica.
7.0 Diagnóstico diferencial Recordar que la persona con cáncer puede padecer dolor de otras etiologías: osteoartrosis, canal estrecho, radiculopatias, neuropatías periféricas, abdomen agudo de origen no neoplásico
8.0 Tratamiento El manejo del dolor crónico de origen oncológico requiere de una adecuada evaluación para elegir la mejor opción de tratamiento. Partiendo del uso de procedimientos sencillos como la terapia farmacológica, la cual es recomendada y validada primordialmente por la Organización Mundial de la Salud por su simplicidad, confiabilidad y alto grado de efectividad, hasta los procedimientos más complicados de tipo intervencionista. Desde hace más de 20 años el enfoque más conocido para el manejo del dolor se ha basado en los tres pasos de la escalera analgésica de la OMS; surgen actualmente diferentes teorías que recomiendan que el enfoque terapéutico debe basarse en los mecanismos fisiopatológicos involucrados en la producción del dolor, para lograr un alivio más rápido y con menos efectos adversos.
9.0 Farmacológico Dolor leve a moderado (intensidad 3 a 6/10):
Predominio somático:
Acetaminofen 500 a 1000 mg cada 6 horas, generalmente 3 gm/dia, máximo 4 gm/dia Si la clínica sugiere componente inflamatorio, Ibuprofeno 400 mg/ 8 horas o Diclofenac 75 mg/12 horas, por 1 semana. Los AINES deben utilizarse con precaución en disfunción renal, anti-coagulación, úlcera péptica, sangrado digestivo reciente, pacientes alérgicos, asma y EPOC.
Predominio visceral: Adicione Bromuro Butil Hiosina 20 mg cada 8 horas. Produce sequedad en la boca. Si no hay respuesta, inicie una mezcla opioide – acetaminofen.
Las opciones disponibles son:
- Acetaminofen-tramadol 325+37.5 mg/ cada 8 horas
Reduzca 30% la dosis de inicio en pacientes mayores de 75 años o con peso menor a 40 Kg.
Prescriba dosis de rescate, 50% de la dosis fija formulada. Si no hay respuesta, aumente la dosis 25 a 50%, teniendo en cuenta no superar 4 gramos de acetaminofen en 24 horas.
En caso de nausea y vomito inicie metoclopramida 10 mg cada 6 horas. Debido a su toxicidad, prescribir metoclopramida profiláctica es cuestionable si se tiene en cuenta que solo 15 a 30% de los pacientes presentan nausea y vomito durante el inicio de la terapia opioide.
Prescriba siempre un laxante en pacientes mayores (ver guía de manejo).
Si no hay respuesta o no es posible titular las dosis inicie morfina, oxicodona o hidromorfona.
Dolor severo (intensidad de 7 a 10):
Según su disponibilidad, es posible iniciar alguno de los siguientes opioides;
- -Morfina al 3% 3 a 5 mg/ cada 4 -6 horas
- -Oxicodona de liberación lenta 10 a 20 mg/ 12 horas
Prescriba dosis de rescate, estas pueden variar entre el 50 y el 100% de la dosis fijas, dependiendo de la intensidad del dolor y la tolerancia desarrollada por exposición previa a opioides. Si utiliza oxycontin; los rescates pueden administrase con la misma presentación.
Seleccione el menor rango de dosis en pacientes mayores de 75 años o con peso menor a 40 Kg.
Si se presentan reacciones adversas que impidan mantener o ajustar dosis, considere la posibilidad de rotar entre los medicamentos arriba mencionados (Ver rotación de opioides).
En caso de analgesia insuficiente, tolerancia o reacciones adversas, interconsulta a la unidad de dolor para evaluar inicio de metadona o vías alternas.
Uso profiláctico de metoclopramida. (ver recomendaciones para nivel 2).
Prescriba laxantes, de acuerdo con la guía de manejo especifica.
Opioides por vías alternas
Subcutánea: Se considera alternativa a la vía oral en pacientes con cáncer que presenten disfagia, mucositis, obstrucción intestinal, alteración de la conciencia, disnea o dolor incidental. Para la técnica del implante ver apéndice.
Medicamentos administrados por esta vía: Morfina o hidromorfona, reducir la dosis 50% con relación a la dosis oral previa (relación de equianalgésia 2:1).
Metoclopramida 10 mg cada 6 horas o haloperiol 5 mg cada 8 horas. Considere de elección el segundo medicamento en pacientes con deterioro funcional avanzado (IK menor del 50%)
Dexametasona 4 mg cada 8 horas.
Midazolam 3 mg cada 8 horas.
SSN09%, DxSS5%, 300 a 500 ml / 24 horas
Transdérmica: En Colombia están disponibles parches para uso transdérmico de fentanil y buprenorfina, indicados en pacientes con intolerancia a la vía oral, dolor sin marcado componente incidental y reacciones adversas a los opioides hidrosolubles en especial estreñimiento.
Inicie un parche de fentanil 25 mcg/72 horas, en pacientes que reciben 90 mg de morfina o su equivalente en 24 horas con otros opioides.
Si prescribe buprenorfina inicie ½ parche cada 4 días.
En casos seleccionados se acepta el uso de parches con dosis previas de morfina de morfina de 40 mg/24 horas.
Prescriba dosis de rescate con un opioide de liberación regular como morfina o hidromorfona. Los estudios con buprenorfina sugieren la posibilidad de utilizar tramadol como analgésico de rescate.
La titulación de los opioides transdérmicos se basa en el consumo de opioides de liberación regular formulados como rescate en 24 horas. Si la dosis en un periodo de 72 horas es igual o mayor a 40 mg de morfina o su equivalente, inicie fentanil por 50 mcg o adicione ½ parche de buprenorfina.
Deben darse instrucciones sobre la forma de uso y complicaciones potenciales de estas presentaciones:
- No rasure la piel para aplicar el parche
- No limpie la piel con alcohol
- No aplique parches en aéreas cruentas
- No utilice parches en pacientes febriles
- Evite el ingreso a saunas o baños de vapor mientras utilice parches.
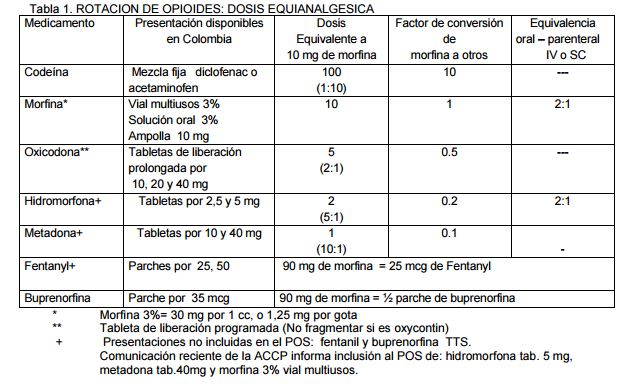
Rotación de opioides: La rotación entre opioides potentes tiene el objetivo de reducir la intensidad de reacciones adversas sobre todo estreñimiento y permitir continuidad del tratamiento en pacientes con intolerancia oral. Algunos ejemplos aceptados para la aplicación para esta técnica son:
Alteración cognoscitiva por morfina; rote a oxicodona oral.
Estreñimiento con morfina, oxicodona o hidromorfona; rote a TTS fentanil o buprenorfina.
Deterioro de la función renal; rote a metadona o fentanil transdermico.
Desarrollo de tolerancia a hidromorfona (posología incomoda, alto consumo de tabletas o ampollas); rote a morfina 3% uso oral o vial multiusos.
Método sugerido para rotar entre opioides potentes: Calcule la dosis del opioide utilizado en 24 horas
Convierta la dosis calculada a su equivalente en morfina utilizando la relación de dosis equianalgésica sugerida ( tabla 1)
Seleccione el opioide para rotar y calcule la dosis equivalente utilizando el factor de conversión sugerido (tabla 1)
Recuerde que las tablas de conversión son el producto de estudios observacionales, no son precisas, ni 4 se ajustan a todas las situaciones.
Reduzca en un 30% la dosis del nuevo opioide (tolerancia cruzada incompleta) y 50% si la dosis previa de morfina es mayor o igual a 300 mg/24 horas, o si el paciente presenta alteración cognoscitiva.
En caso de rotar a metadona tenga en cuenta que las dosis equianalgesicas varían dependiendo de la dosis previa de morfina en 24 horas así;
- Menor de 100mg 5:1 (5 veces más potente que morfina)
- Hasta 200 mg 10:1 (10 veces más potente que morfina)
- Más de 200 mg 14:1
INDICACION PARA PRESCRIBIR CO-ANALGÉSICOS
Metástasis Óseas: Combine analgésicos con diferente mecanismo de acción (AINES/ acetaminofen / opioides)
Después de evaluar riesgo-beneficio, inicie dexametasona 8 mg SC o prednisolona 5 mg VO día, ciclos de 10 días.
Considere el uso de Bifosfonatos, Zoledronato o Ibandronado, según disponibilidad, cada 4 semanas de acuerdo con recomendaciones específicas de infusión y seguimiento.
En pacientes sin respuesta a radioterapia es posible considerar tratamiento con radiofármacos (estroncio, samario o renio) siempre que su estado funcional lo justifique.
10.0 Intervencionismo
El manejo intervencionista del dolor de origen oncológico, es considerado como una importante alternativa analgésica confiable, predecible y que puede beneficiar a un importante número de pacientes que no responden satisfactoriamente al tratamiento farmacológico o que desean un control analgésico libre de fármacos , y que además es compatible con el manejo extrahospitalario del paciente. En caso de que el dolor provenga de áreas bien delimitadas con inervación limitada a un grupo nervioso específico se pueden considerar los procedimientos neurolíticos con radiofrecuencia o agentes neurolíticos como alcohol o fenol. En casos de dolor generalizado o de difícil manejo se puede considerar la colocación de dispositivos para administración de analgésicos por via espinal, epidural o endovenosa. Los procedimientos intervencionista para el manejo del dolor pueden ser: Infusión subcutánea, endovenosa (PCA), bloqueos neurales diagnosticos o 5 terapéuticos somáticos y simpáticos, vertebroplastia, infusión intratecal o peridural y neuromodulación neural, medular y cortical.
11.0 Bibliografía 1. De Leon-Casasola O. Current developments in opioid therapy for management of cancer pain. Clin J Pain. 2008; 24-Supplement: S3-S7. 2. McGeeney BE. Adjuvant Agent in Cancer Pain. Clin J Pain. 2008; 24-Supplement: S14-20. 3. Delaney A, Fleetwood-Walker SM, Colvin LA, Fallon M. Translational medicine: cancer pain mechanisms and management. British Journal of Anaesthesia 2008; 101 (1):87-94 4. Driver LC. Managing cancer pain: Practical principles and pearls for pragmatic polypharmacy. Clin J Pain. 2008; 24-Supplement: S1-S2. 5. Rodríguez RF, Daza P, Rodríguez MF. Uso de buprenorfina transdérmica en el alivio del dolor por cáncer. Rev Col Anest. 2006; 34:253-257. 6. Rodríguez RF, Castillo JM, Castillo MP et al. Hydrocodone/acetaminophen and Tramadol Clorhhydrate combination tablets for the management of chronic cancer pain: A double blind comparative trial. Clin J Pain. 2008; 24:1-4. 7. Rodríguez RF, Bravo LE. Determinación de la dosis oral inicial de opioides débiles en alivio del dolor por cáncer. Rev. Col. Anest. 2003; 31: 93-103. 9. Rodríguez RF, Bravo LE, Castro F et al. Incidence of weak opioids adverse events in the management of cáncer pain: A doublé blind comparative tyrial. Journal of Palliative Medicine. 2007; 10: 56-60.